
| ポータルTop | 生化学 | 細胞生物学 | 汎用実験試薬・器具 | バルク・カスタム試薬 |
復習しませんか 1
バッファーの基礎知識(1) pHとpKa
およそすべての生体内作用は pH依存性です。たとえわずかでも、pHの変化は代謝性アシドーシスやアルカローシスの原因となり、代謝不全が発生します。バッファーは生体内において、pHを極めて狭い範囲内に保ち、細胞内外の影響により生じるpHの変化を最小限に抑える抵抗系として機能することで、代謝を正常に進行させます。
pHとpKa、ヘンダーソン-ハッセルバルヒ式
水素イオンの濃度を対数表示した数値が水素イオン指数(pH)です。
一般にpHが0から14の値を取ることはよく知られています。これは、水のイオン積が1気圧25℃においてほぼ一定である事に基づいています。
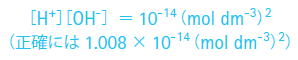
pH、pKaと弱酸、その共役塩基の緩衝作用における関係は次に紹介するヘンダーソン-ハッセルバルヒ式でよく説明されます。
生物学的実験においては、[H+]は10-1mol/L(M)から10-10Mまで変化します。
pHと同様に、弱酸や弱塩基の酸解離定数Kaに対してはpKaが定義されます。たとえば酢酸の場合、下記の平衡式からpHとpKaの関係が導き出されます。

式中の酢酸イオン濃度と酢酸濃度が等しい時、つまり50%の分子が電離している時、log[CH3COOH]/[CH3COO-]はゼロ(log1)に近づき、pHはpKaに等しくなります(酢酸のpKaは4.745)。このpHの付近では、H+の増加はCH3COO-+H+ → CH3COOHの反応を、OH-の増加は(CH3COOHに由来する)H+ + OH- → H2Oの反応を促進するため、酢酸と酢酸イオンはpH 4.745付近を中心に効果的な緩衝システムを形成します。一般的に、弱酸あるいは弱塩基のpKaは緩衝領域中心のpHを示します。
生体内における水とバッファーの役割
全ての生物学的反応は水性溶媒中で起こります。これは、細胞の構造と機能は水の物理的性質ならびに化学的性質に依存することを意味しています。水はほぼ全ての塩を溶解し、解離した陽イオンと陰イオンを水和して安定化する役割をもち、生体反応の基盤を作る極性溶媒です。
組織内には水分子と共に弱酸と弱塩基が存在します。弱酸や弱塩基は溶液中で完全に解離せず、非解離状態(分子)と解離状態(イオン)の平衡混合物の状態をとります。このイオン化反応の指標の一つが、イオン化定数あるいは解離定数と呼ばれる平衡定数であり、弱酸や弱塩基による緩衝作用の指標でもあります。生体内は、複数の酸と塩基がバッファーとして機能する緩衝系です。
等電点とpKa
バッファーは可逆的に反応する弱酸(プロトン供与体)とその共役塩基(プロトン受容体)から構成される緩衝系で、両者の濃度がほぼ等しい溶液では、前述の通り少量の酸や塩基の添加はpHにほとんど影響を及ぼしません。この点は一般的に等電点としても知られています。すなわち、等電点では正味電荷がなく、pH = pKaです。
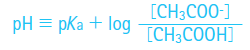
たとえば酢酸の等電点では[CH3COO-]=[CH3COOH]であり、pH = pKaです。
pHに対する温度の影響
一般的に、分子の緩衝作用の議論は次の2点の上に成り立っています。
1) 緩衝作用を発揮する範囲では、バッファーイオンの活量係数はおおよそ1に等しい
2) Kaは一定である
しかし、実際にはpKaは温度変化に対して一定ではなく、温度の上昇と共に値がわずかに小さくなる事が知られています。ヘンダーソン - ハッセルバルヒ式から、pKaの変動はpHにも影響を与える(緩衝能が大きいpHの範囲では、液温が変化するとpKaに近づくようなpHの変化が起こる)事が分かります。これは化学反応効率を最大に保つために正確な水素イオン濃度が要求される生体システム中におい て、非常に重大な点です。
図1は、リン酸バッファーのpHに対する温度の影響を示しています。差異はわずかのように見えるかもしれませんが、このわずかな変化が、生体内の化学反応に大きな影響を与えます。活性と温度の数学的関係は複雑ですが、温度あたりのpKaの実際の変化率(ΔpKa/℃)はおおむね直線性を示します。
表1は、生物学的な実験で通常使用されるいくつか両イオン性バッファーに対するpKaとΔpKa/℃を示したものです。


お問合せ先
- On-Lineフォーム:製品・技術に関するお問合せ
- TEL(テクニカルサービス):03-4531-1140
- TEL(ご注文関連):03-4531-1141
※掲載価格は希望販売価格(税別)です。実際の価格は弊社製品取扱販売店へご確認ください。なお、品目、製品情報、価格等は予告なく変更される場合がございます。予めご了承ください。
シリーズ目次
●最寄の販売店をお探しなら
メルク ライフサイエンス取扱販売店一覧
●製品カタログをお探しなら
製品カタログ一覧/印刷版請求
●製品変更・発売中止のご案内は
バイオサイエンス製品の変更・発売中止のご案内
●試薬の新製品情報は
新製品ファインダー(毎月更新)






